Hablemos de química.
La parte esencial de ésta se concentra en la formación de compuestos a partir de los elementos químicos y el estudio de estos en cuanto a su funcionalidad, efectos y usos. Es así como podemos dividirla en dos partes, inorgánica y orgánica, para efectos de comodidad en este blog.
Átomos, moléculas y compuestos
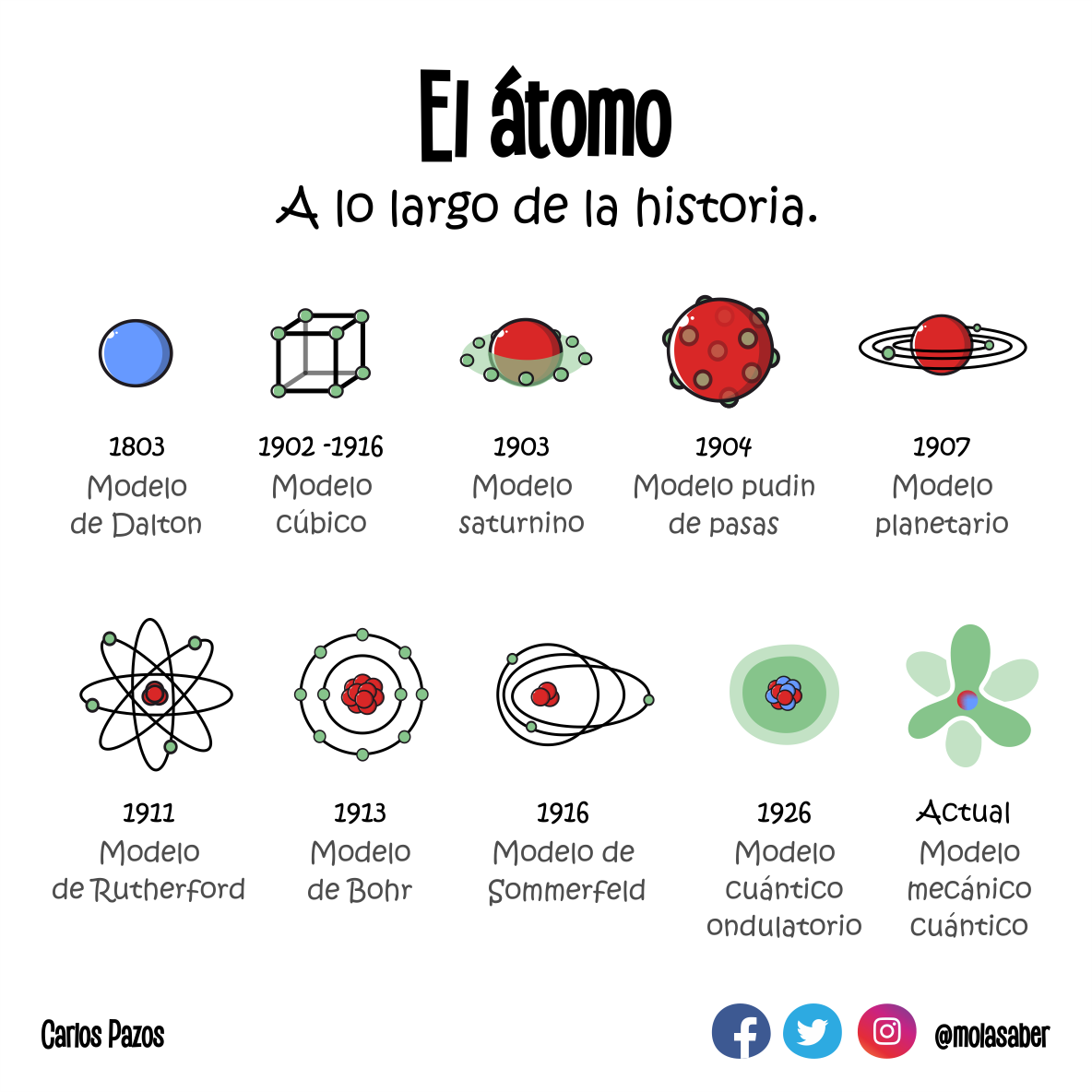 Créditos de imagen a Carlos Pazos.
Créditos de imagen a Carlos Pazos.Ahora bien, los elementos no son individualistas, a ellos les gusta combinarse o unirse con otros para formar lo que llamamos moléculas y éstas a su vez se unen entre sí para formar compuestos químicos. Una molécula es un conjunto de átomos de un mismo elemento o de elementos diferentes unidos entre sí por enlaces químicos mientras que un compuesto es un conjunto de átomos o moléculas de un mismo elemento o de elementos diferentes unidos entre sí por enlaces químicos.
Sólo los elementos que son gases nobles se encuentran normalmente en la naturaleza como átomos aislados. La mayor parte de la materia está compuesta de moléculas o iones, esto se debe a que diversos elementos se encuentran en la naturaleza en forma molecular: dos o más átomos del mismo se unen entre sí. Por ejemplo, la mayor parte del oxígeno en el aire consiste en moléculas que contienen dos átomos de oxígeno.
Una molécula formada por dos átomos se conoce como molécula diatómica. Los elementos que normalmente existen de esta manera son el hidrógeno, el oxígeno, el nitrógeno y los halógenos (H2, O2, N2, F2, Br2 e I2), excepto por el hidrógeno, esos elementos diatómicos están aglutinados en el lado derecho de la tabla periódica.
Los compuestos formados por moléculas que contienen más de un tipo de átomos se conocen como compuestos moleculares. Por ejemplo, una molécula del compuesto metano consiste en un átomo de carbono y cuatro átomos de hidrógeno y por lo tanto se representa con la fórmula química CH4.
Las fórmulas químicas que indican los números y tipos de átomos reales en una molécula se conocen como fórmulas moleculares. Por su parte, las fórmulas químicas que solo proporcionan el número relativo de cada tipo de átomos en una molécula se conocen como fórmulas empíricas.
Referencias bibliográficas
1. Rodríguez J, Bor M, Mondragon C, Peña L, Sanchez M y Escalante F. Química. Caracas: Santillana; 2008.
2. Machin J. CAMINO A LA UNIVERSIDAD: QUÍMICA. Venezuela: IVITEG; 2011.
3. Pérez, Garduño, Rodríguez, Burns, Timberlake, Daub y Seese. Química I. México: Pearson educación; 2010.


Comentarios
Publicar un comentario